·María Dolores Zambrano Croche. Estudiante de Grado de Farmacia por la Universidad de Sevilla.
·Marina Sánchez Hidalgo. Profesora Titular de Universidad, Universidad de Sevilla. Departamento de Farmacología. Cuenta de twitter: @shmarinash. Cuenta de Instagram: @farmaus
Foto principal: Tomado de Kiesgen et al., 2018
DEFINICIÓN DE LA TERAPIA CAR-T
La terapia CAR-T es un tipo de inmunoterapia utilizada en el tratamiento del cáncer. Esta terapia ha avanzado mucho en los últimos años con prometedores resultados sobre todo en pacientes con neoplasias hematológicas. De hecho, ya hay dos terapias CAR-T autorizadas por diferentes agencias de medicamentos como la FDA (en EEUU), la EMA (en Europa) y la AEMPS (en España). Sin embargo, en el caso de los tumores sólidos todavía no existe ninguna aprobación debido a la complejidad que presentan.
Para entender mejor esta terapia, podemos comenzar definiendo de forma muy general la inmunoterapia. Este citado tratamiento consiste en mejorar la capacidad del sistema inmunitario para combatir el cáncer. Los tipos de inmunoterapia se pueden dividir en dos grupos: aquellos que ayudan al sistema inmunitario a contraatacar directamente al tumor o los que aumentan la respuesta inmune en general. Dentro del primer grupo se distinguen distintos tratamientos, uno de ellos es la transferencia celular adoptiva, y dentro de este se encuentra la terapia CAR-T.
La transferencia celular adoptiva se basa en infiltrar al paciente aquellos linfocitos T que presentan una alta afinidad por los antígenos asociados a tumores. Como hemos dicho anteriormente dentro de este tipo de tratamiento se encuentra la terapia CAR-T, ya que esta también se basa en la infiltración al paciente de linfocitos T, células T con alta afinidad por antígenos tumorales. La afinidad a estos antígenos tumorales se consigue por medio de un receptor sintético, denominado receptor de antígeno quimérico, CAR (son las siglas en inglés del receptor, de ahí el nombre de la terapia, “CAR” por el receptor y “T” por ser las células T las que expresan dicho receptor).
El receptor de antígeno quimérico es un receptor sintético, como se ha dicho anteriormente, el cual se trata de una proteína que se encuentra en la membrana de la célula. Si describimos de forma muy esquemática dicho receptor diríamos que consta de un dominio extracelular (el cual se trata de un fragmento variable de cadena sencilla, que es el que se une al antígeno tumoral específico), la región bisagra, el dominio transmembrana y el dominio intracelular (el cual posee la cadena zeta del complejo CD3, cuyo objetivo es la activación de la célula T, y también puede tener uno o dos complejos de coestimulación que mejoran la respuesta de las células T).
Podemos recapitular y de forma resumida decir que la terapia CAR-T, es un tipo de inmunoterapia, en la que se le extraen al paciente sus linfocitos T para manipularlos genéticamente en el laboratorio, y así dotarlos con un CAR (un receptor de antígeno quimérico) que va a reconocer solo a un antígeno tumoral determinado, específico. Después, se le infunden los linfocitos T modificados al paciente. En el interior del organismo, estos linfocitos T modificados, las células CAR-T, reconocen y se unen a un antígeno tumoral específico gracias al CAR, y como consecuencia de este hecho las células CAR-T se activan, proliferan, secretan citocinas y matan a las células cancerosas que expresen en la membrana celular el antígeno tumoral específico.
PROCEDIMIENTO
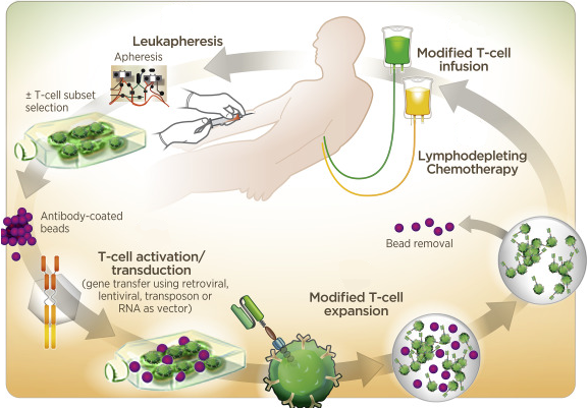
Etapas de la terapia CAR-T. Tomado y modificado de Frey, 2017.
En cuanto al procedimiento, hay distintas etapas en el desarrollo y producción de esta terapia, desde la evaluación de los posibles pacientes, pasando por el propio proceso de elaboración de las células CAR-T, hasta llegar a administrar las células CAR-T al paciente y su posterior monitorización. A continuación, en los párrafos siguientes se explicarán brevemente las etapas que se llevan a cabo en esta terapia.
El primer paso en este tratamiento consiste en la evaluación de los pacientes para saber si esta terapia es la indicada, y si es segura en ellos. Algunas características que tienen que tener los pacientes son: poseer un cáncer que sea positivo para el antígeno al que se dirige el CAR, tener un número suficiente de linfocitos que se puedan recolectar para fabricar las CAR-T, no tener una infección activa no controlada, no tener ciertas afecciones cardiovasculares, neurológicas o inmunológicas, y en general un buen estado funcional.
El segundo paso es la extracción de los linfocitos T mediante un proceso denominado leucoaféresis, en el cual se debe recoger un número mínimo de células T CD3 +, este procedimiento puede durar entre 2-3 h, en el caso de niños es más lento. La aféresis debe realizarse pasado más de 3 meses en pacientes con alotrasplante de progenitores hematopoyéticos, además tienen que dejar de tomar fármacos inmunosupresores, y no tener la enfermedad injerto contra el huésped. La quimioterapia, la L-asparraginasa, y los corticoides no deben tomarse, al menos durante las 2 semanas, 4 semanas y 72 horas (respectivamente) antes de la aféresis. El producto de aféresis se etiqueta, se crioconserva (es decir, se congela), y se almacena hasta su transporte al lugar de fabricación.
En el tercer paso, ya en el centro de fabricación, las células T se activan. En esta etapa se quiere producir una expansión ex vivo (fuera del paciente) de los linfocitos T, es decir, se quiere obtener una mayor cantidad de estas células T para su manipulación en las etapas posteriores. Para ello se pueden utilizar diferentes estrategias como: utilización de células dendríticas, o de células presentadoras de antígeno artificiales, también para dicha expansión se recurre a perlas magnéticas recubiertas de anticuerpos, o simplemente se activan mediante anticuerpos e interleuquinas.
El cuarto paso se trataría de la manipulación genética de las células T, para introducirle el gen que exprese el CAR que se dirige a un antígeno asociado a tumor específico. Para la transferencia del gen CAR existen diferentes formas siendo la más común y eficaz mediante transducción viral, utilizando vectores retrovirales o vectores lentivirales, empleándose más los vectores lentivirales. Podemos decir de una forma más sencilla, que el método más habitual para que el linfocito T del paciente posea en su membrana el receptor CAR es mediante la utilización de virus (en concreto retrovirus o lentivirus) que van a transferir el gen CAR al linfocito T.
En el quinto paso se produce la expansión de las células T ya modificadas, es decir, de las células CAR-T. El procedimiento de expansión, de obtener una mayor cantidad de estas células CAR-T, se puede realizar en: matraces de cultivo celular, bolsas de cultivo estáticas, diferentes tipos de biorreactores o dispositivos. Luego, las células CAR-T se lavan, concentran, crioperservan (se congelan) y transportan al centro donde se las administrarán al paciente. En la producción es necesario realizar pruebas de control de calidad del producto.
El sexto paso consiste en la quimioterapia de linfodepleción que debe realizarse días antes de la infusión de las células CAR-T. Es recomendable tener el producto en el hospital antes de comenzar con esta quimioterapia de dosis bajas (suele ser con fludarabina y ciclofosfamida), pues si hubiese un retraso en el envío del fármaco vivo, de las CAR-T, y el recuento de linfocitos fuese de más de 1000 células/l, habría que repetir la quimioterapia. Desde la aféresis hasta la llegada del producto pueden transcurrir unas 3 o 4 semanas. El objetivo de la linfodepleción es conseguir una mejor expansión y persistencia de las CAR-T, además de reducir la carga tumoral y así tener una eficacia mayor y una toxicidad menor. Durante el tiempo de espera de la terapia CAR-T, puede ser necesario una quimioterapia puente para controlar la enfermedad en caso de cáncer agresivo.
En el séptimo paso se administra la infusión de las células CAR-T, antes de ello para evitar reacciones agudas por la infusión, se puede administrar paracetamol o difenhidramina u otro antihistamínico H1, pero no corticoides. Estas recomendaciones se recogen en la ficha técnica de los dos productos ya comercializados, de los cuales se hablará posteriormente. El paciente debe encontrarse en buen estado general, si no se retrasará la perfusión. La dosis de células infundidas varía según el protocolo. Se alcanzan unos niveles máximos de las células CAR-T a la primera o segunda semana después de la infusión. Se ha relacionado la expansión y la persistencia de estos linfocitos T modificados con la eficacia.
Cabe destacar que, debido a las posibles reacciones adversas, que a veces pueden llegar a ser graves como el síndrome de liberación de citocinas o el síndrome neurológico asociado a células inmunoefectoras, es necesario la monitorización del paciente durante los 10 primeros días tras la infusión. Después, se debe seguir monitorizando al paciente, pero según lo estime el médico. El paciente debe permanecer durante 4 semanas cerca del centro donde se le atendió por los posibles efectos adversos.
INDICACIONES
Esta terapia como se indicó al principio del artículo ha tenido un mayor éxito en neoplasias hematológicas y no tanto en tumores sólidos por su complejidad. En concreto hay un mayor avance y éxito en las neoplasias malignas de células B. La mayoría de los CAR utilizados en estas neoplasias se dirigen al antígeno CD19, presente en la superficie de las células B. Se eligió como objetivo del CAR al antígeno CD19 por su alta y amplia extensión en leucemia y linfomas de células B. También esta terapia se está estudiando en otras neoplasias hematológicas como la leucemia mieloide aguda y el mieloma múltiple.
Actualmente hay dos terapias aprobadas y comercializadas tanto por la FDA, la EMA y la AEMPS. Las terapias son tisagenlecleucel, cuyo nombre comercial es Kymriah del laboratorio Novartis y axicabtagene ciloleucel, cuyo nombre comercial es Yescarta del laboratorio Gilead. Los dos tratamientos se tratan de células CAR-T CD19, es decir se dirigen y unen al antígeno CD19.
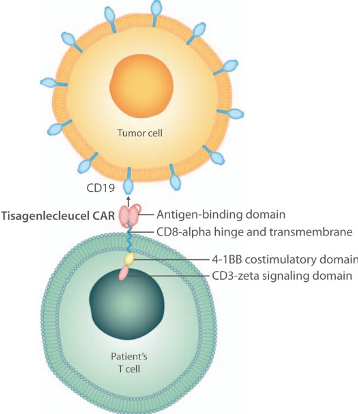
Tomado de Buechner et al., 2018.
Las indicaciones aprobadas por la AEMPS para tisagenlecleucel son para pacientes pediátricos y adultos jóvenes de hasta 25 años con leucemia linfoblástica aguda de células B refractaria, en recaída post-transplante o en segunda o posteriores recaídas. Y en pacientes adultos con linfoma B difuso de células grandes recidivante o refractario después de dos o más líneas de tratamiento. En el caso de axicabtagene ciloleucel, la AEMPS indica este medicamento para pacientes adultos con linfoma B difuso de células grandes refractario o en recaída y linfoma B primario mediastínico de células grandes después de dos o más líneas de tratamiento sistémico.
Se cree que las próximas terapias comerciales que podrían aprobarse para cánceres hematológicos, serán el CAR-T bb2121 para mieloma múltiple recidivante/refractario y el CAR-T lisocabtagene maraleucel para algunos tipos de linfomas no Hodgkin recidivante/refractario incluyendo: linfoma B primario mediastínico, linfoma folicular, linfoma de células del manto y linfoma B difuso de células grandes). El primer CAR-T se dirige contra el antígeno BCMA y lisocabtagene maraleucel se dirige contra CD19.
RESULTADOS ESPERADOS
Con las terapias CAR-T CD19 en pacientes con leucemia linfoblástica aguda de células B recidivante/refractario, se han llegado a alcanzar tasas de respuesta completa del 90%. En el caso de pacientes con linfoma de células B no Hodgkin recidivante/refractario se ha llegado a obtener una tasa de respuesta completa alrededor de un 50-60%. En el caso de los posibles próximos tratamientos aprobados se ha conseguido una tasa de respuesta completa del 45 % y una tasa de respuesta objetiva del 85 % con el CAR-T bb2121, y una tasa de respuesta completa del 60 % con lisocabtagene maraleucel.
Para comprender mejor estos resultados vamos a definir que es la tasa de respuesta completa y objetiva. La tasa de respuesta objetiva es el porcentaje de pacientes que tras el tratamiento se observa que el tamaño del tumor ha disminuido o desaparecido. Y la tasa de respuesta completa es el porcentaje de pacientes que tras el tratamiento se produce la desaparición del tumor.
VENTAJAS E INCONVENIENTES
Los avances que se están obteniendo en esta terapia son importantes para aquellos pacientes con estas neoplasias hematológicas que no responden al tratamiento, o bien tienen recaídas, y sus pronósticos no son buenos. Aunque hay que tener en cuenta ciertas limitaciones de esta terapia como son: las reacciones adversas que pueden llegar a ser graves, el coste de la terapia, la eficacia de esta en los tumores sólidos como hemos comentado a lo largo del artículo, el tiempo de producción y la resistencia de la terapia vista en algunos casos.
En cuanto a las reacciones adversas, que pueden ocasionar las células CAR-T CD19 son: síndrome de liberación de citocinas (SLC), síndrome neurológico asociado al tratamiento con células inmunoefectoras (ICANS), síndrome de activación macrofágica/ linfohistocitosis hemofagocítica (SAM/LHH), infecciones y neutropenia febril, citopenias prolongadas, hipogammaglobulinemia debido a la aplasia de células B, y síndrome de lisis tumoral entre otros. Dentro de estas reacciones adversas destacamos el síndrome de liberación de citocinas y el síndrome neurológico asociado a células inmunoefectoras.
El síndrome de liberación de citocinas se trata de una respuesta inflamatoria sistémica como consecuencia de los altos niveles de citocinas en sangre, en particular la IL-6 (interleuquina 6), debido a la expansión y activación de células CAR-T. Este efecto secundario suele ser reversible, es decir suele desaparecer. Dependiendo de la gravedad de esta reacción adversa se diferencia hasta 4 grados dentro del síndrome de liberación de citocinas. Los síntomas pueden ser diversos, algunos de ellos son: fiebre alta, cansancio, artralgia (dolor de las articulaciones), mialgia (dolor en los músculos), náuseas, anorexia (pérdida del apetito), vómitos, hipotensión, disnea (dificultad respiratoria), taquipnea (aumento de la frecuencia respiratoria), hipoxia (baja concentración de oxígeno en tejidos) y disfunción orgánica (pulmonar, cardiaca, renal y hepática).
El síndrome neurológico asociado a células inmunoefectoras, es un efecto secundario que puede ocurrir junto con el síndrome de liberación de citocinas, después de este o en su ausencia. Muchas veces los síntomas son reversibles, pero ha habido algún caso de edema cerebral y muerte. Dependiendo de la gravedad del síndrome neurológico asociado a células inmunoefectoras existen hasta cuatro grados. Los síntomas son encefalopatía, confusión, delirio, convulsiones, afasia (trastorno del lenguaje), alteración del habla, dolor de cabeza, debilidad motora, y nivel de conciencia deprimido.
Los posibles efectos adversos se controlan mediante protocolos de actuación, que informan cómo manejar las reacciones adversas según cuál sea y su gravedad, cuáles son los procedimientos a seguir y qué medicación es necesario administrar. En España dichos protocolos se han elaborado y se siguen dentro del sistema nacional de salud. Para mejorar la seguridad de estas terapias se sigue investigando en el diseño de los receptores de antígeno quimérico.
Si nos centramos en el aspecto económico, estas terapias tienen un coste muy elevado para los pacientes. Por ejemplo, las dos CAR-T ya comercializadas, mencionadas anteriormente, tienen un precio de 475.000$ para tratar la leucemia linfoblástica aguda de células B y 373.000$ para tratar el linfoma difuso de células B grandes. Sin embargo, en España el sistema nacional de salud cubre los dos tratamientos tanto Kymriah, como Yescarta.
Desde la aféresis hasta la llegada de las células CAR-T al centro de administración pueden transcurrir unas 3 o 4 semanas. Por lo que se puede decir que el proceso de producción es relativamente lento, pues hay que tener en cuenta que durante ese periodo de tiempo el paciente puede empeorar. Para resolver este problema también se están investigando células CAR-T alogénicas. Esto quiere decir que para la fabricación de las CAR-T en vez de utilizar los linfocitos T del paciente, se utilizarían linfocitos T de donantes con “ciertos cambios genéticos” para evitar que se produzca la enfermedad de injerto contra el huésped, de esta manera serían células CAR-T listas para administrar, y el paciente no tendría que esperar.
Por último, mencionar que existen ciertos casos de resistencia a la terapia, que puede ser debido a una baja permanencia de las CAR-T en el interior del organismo, a los anticuerpos que atacan a los CAR (pues el sistema inmunitario puede reconocer a una parte del receptor de origen murino como extraño) o al escape tumoral que consiste en la pérdida de antígeno por parte de las células tumorales.
REFERENCIAS
Abken H, Wels WS, Kühlcke K. The Express Drivers: Chimeric Antigen Receptor-Redirected T Cells Make It to the Clinic. En: Britten CM, Kreiter S, Diken M, Rammensee HG. Cancer Immunotherapy Meets oncology. Ed. Springer, 2014. p. 127-135
Agustí MA, Alcaraz M, Bello JL, Calvo G, Camarero J, Duarte RF, et al. Protocolo clínico para el manejo de los efectos adversos graves en pacientes tratados con CAR-T 19. 2019 [en línea]. [Consultado en dic. 2019]. Disponible en: https://www.mscbs.gob.es/profesionales/farmacia/pdf/20190508_Protocolo_manejo_efectos_adversos_CAR_T.pdf
Buechner J, Kersten MJ, Fuchs M, Salmon F, Jäger U. Chimeric Antigen Receptor-T Cell Therapy. Practical Considerations for Implementation in Europe. Hemasphere. 2018; 2(1):e18
Chomienne C, Sierra J, Einsele H, Jäger U. EHA Guidance Document The process of CAR-T cell therapy in Europe. Hemasphere. 2019; 3(4): e280
Cruz-Ramos M, García-Foncillas J. CAR-T cell and Personalized Medicine. Adv Exp Med Biol. 2019; 1168:131–45.
EMA. Kymriah: EPAR-Product information. 2018 [en línea]. [Consultado en dic. 2019]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/kymriah-epar-product-information_es.pdf
EMA. Yescarta: EPAR-Product information. 2018 [en línea]. [Consultado dic. 2019]. Disponible en: mationhttps://www.ema.europa.eu/en/documents/product-information/yescarta-epar-product-infor_es.pdf
Frey N. The what, when and how of CAR T cell therapy for ALL. Best Pract Res Clin Haematol. 2017; 30(3):275-281
Jackson HJ, Rafiq S, Brentjens RJ. Driving CAR T-cells forward. Nat Rev Clin Oncol. 2016; 13(6):370-83.
June CH, O’Connor RS, Kawalekar OU, Ghassemi S, Milone MC. CAR T cell immunotherapy for human cancer. Science. 2018; 359(6382):1361-1365
Kiesgen S, Chicaybam L, Chintala NK, Adsumilli PS. Chimeric Antigen Receptor (CAR) T-Cell Therapy for Thoracic Malignancies. J Thorac Oncol. 2018; 13 (1):16-26
Levine BL, Miskin J, Wonnacott K, Keir C. Global Manufacturing of CAR T Cell Therapy. Mol Ther Methods Clin Dev. 2017; 4:92-101
LLS. Facts About Chimeric Antigen Receptor (CAR) T-Cell Therapy. 2018 [en línea]. [Consultado dic. 2019]. Disponible en: https://www.lls.org/sites/default/files/National/USA/Pdf/Publications/FSHP1_CART_Factsheet_June2018_FINAL.pdf
Maude SL, Teachey DT, Porter DL, Grupp SA. CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia. Blood. 2015;125(26):4017–23.
McGuirk J, Waller EK, Qayed M, Abhyankar S, Ericson S, Hollman P, et al. Cytotherapy. 2017; 19(19):1015-1024
NCI. Inmunoterapia para el cáncer. 2018 [en línea]. [Consultado en nov. 2019]. Disponible en: https://www.cancer.gov/espanol/cancer/tratamiento/tipos/inmunoterapia
NIH. Study Evaluating the Safety and Pharmacokinetics of JCAR017 in B-cell Non-Hodgkin Lymphoma (TRANSCEND-NHL-001). 2019 [en línea]. [Consultado en dic. 2019]. Disponible en: https://clinicaltrials.gov/ct2/show/NCT02631044?cond=NCT02631044&draw=2&rank=1
Raje N, Berdeja J, Lin Y, Siegel D, Jagannath S, Madduri D, et al. Anti-BCMA CAR T-Cell Therapy bb2121 in Relapsed or Refractory Multiple Myeloma. N Engl Med. 2019; 308(12):1726-1737
Roche. Objetivos de un ensayo clínico. 2015 [en línea]. Disponible en: https://rochepacientes.es/objetivos-de-un-ensayo-clinico/
Sánchez M, Yáñez L, Urbano A, Perales MA. CAR T cells: The future is already present. Med Clin (Barc). 2019; 152(7):281-286
Silbert S, Yanik GA, Shuman AG. How Should We Determine the Value of CAR T-Cell Therapy? AMA J Ethics. 2019; 21(10):E844-851
Vormittag P, Gunn R, Ghorashian S, Veraitch FS. A guide to manufacturing CAR T cell therapies. Curr Opin Biotechol. 2018; 53:164-181
Wang X, Rivière I. Clinical manufacturing of CAR T cells: foundation of a promising therapy. Mol Ther Oncolytics. 2016; 3:16015



